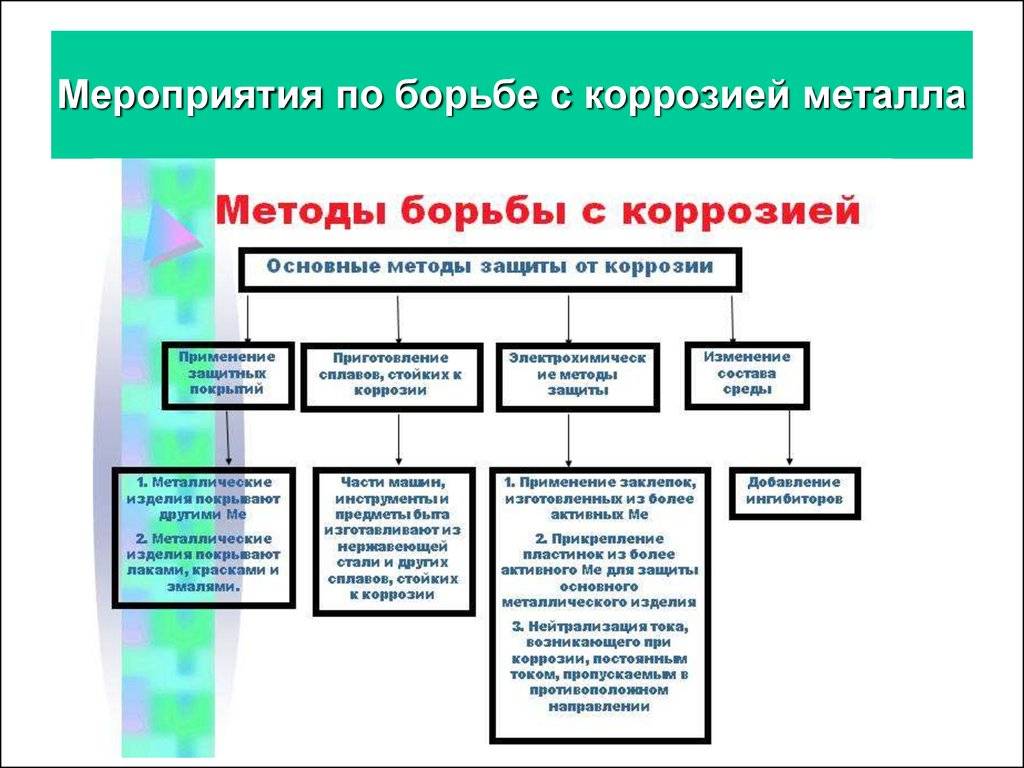
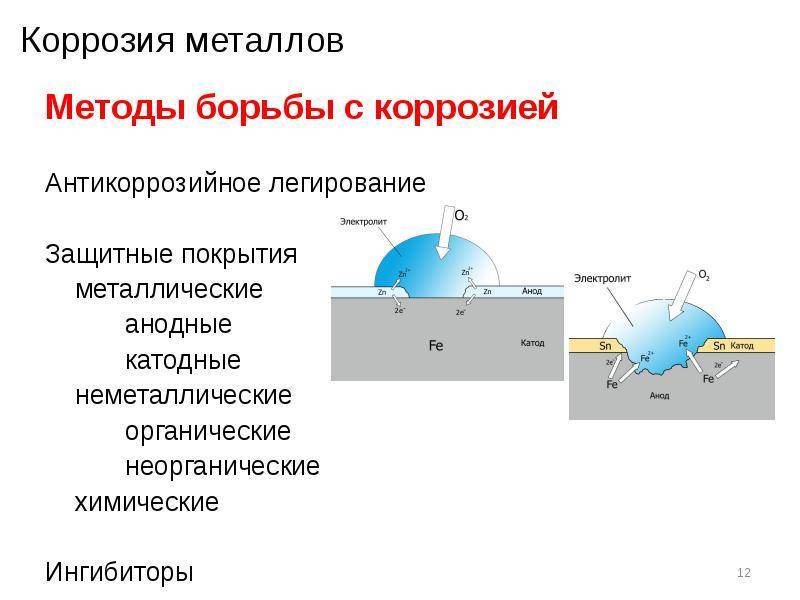
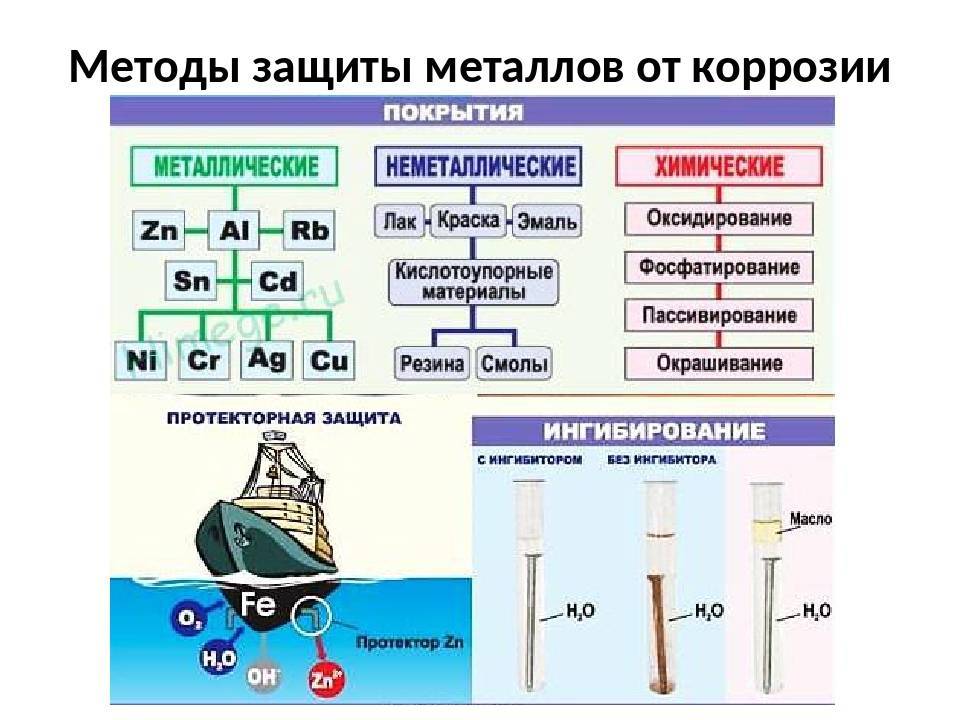
Описание процесса
Электрохимическая коррозия — это процесс, который протекает при обязательном присутствии:
- электролита;
- металлов с низким и высоким окислительно-восстановительными потенциалами (электродные потенциалы).
Электролит образуют вода, конденсат, любые природные осадки. Наличие двух видов металла практически не бывает всегда, и обусловлено двумя факторами:
- Неоднородностью изделия, то есть наличием инородных включений.
- Непосредственным касанием изделий из различных металлов.
В электролите неоднородные металлы образуют короткозамкнутый гальванический элемент, называемый коррозионным. Такое сочетание приводит к растворению металла с более низким электродным потенциалом, что и называют электрохимической коррозией. Скорость этого процесса сильно зависит от наличия солей в растворе и его температуры.
Проверьте себя
Что такое коррозия?
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
Гидроксид железа Fe(OH)3 называют:
а ржавчина;
б) окалина;
в) патина.
Что является причиной возникновения коррозии?
Чем отличаются химический и электрохимический типы коррозии?
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
КЛАССИФИКАЦИЯ КОРРОЗИИ
Самый распространенный вид коррозии — ржавчина, но коррозия и ржавчина — не синонимы. Есть и другие виды коррозии, которые не менее, а порой и более пагубны для нефтегазового оборудования, в частности, так называемая щелевая коррозия и коррозия под напряжением.
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Сегодня каждая научная область — физика, химия, биология — классифицирует коррозионные процессы, основываясь на собственных научных позициях, а единой, всеобъемлющей и общепризнанной классификации коррозии пока не создано. На наш взгляд, лучше всего рассматривать процесс коррозии с точки зрения физико-химической механики, так как она максимально объединяет научные течения, что, в свою очередь, дает возможность получить наиболее полную картину видов коррозии.
Так или иначе, сегодня существует несколько классификаций коррозии по различным признакам (см. «Классификация коррозии по различным признакам»). При этом надо учитывать, что на практике гораздо чаще встречается совмещение видов коррозии, нежели какой-либо вид в отдельности.
Виды коррозии
Срок службы металлических конструкций учитывают при проектировании производственных мощностей, мостов, зданий. В некоторых химических производствах отдельные аппараты и их детали работают только несколько месяцев или недель.
В зависимости от причины разрушения выделяют 3 вида коррозии: атмосферная, почвенная, жидкостная. Рассмотрим их особенности.
- Атмосферная — проявляется под воздействием активных химических веществ в воздухе.
- Почвенная — происходит при взаимодействии металла с агрессивным составом грунтовых вод, почвы.
- Жидкостная — возникает при контакте с водной средой с высоким содержанием солей, которые ускоряют окисление.
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде
2H + +2e — = H2разряд водородных ионов
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Коррозия металлов под землей
Существует вред для металлов не только на поверхности, но и под землей. В настоящее время на некоторой глубине достаточно часто залегают металлические коммуникации, которых постепенно уничтожает электрокоррозия. Для борьбы с таким типом коррозии необходимо:
- Отстранять телекоммуникационные трасы от рельс электрифицированного транспорта (проблема в блуждающих токах);
- Увеличить сопротивление трубопровода и пространства в грунте;
- Монтаж изолирующих фланцев;
- Повышение электропроводимости трубопроводов и монтаж на сальниковых компенсаторах токопроводящих перемычек;
- Регулировать допустимое уравнивание потенциалов в сети параллельных трубопроводов.
- Установка поперечных перемычек.
Где бы не находился металлический элемент, на воздухе, под землей или в помещении, его в любом случае нужно обрабатывать. Правильно подобранные краски и их качество будет залогом успешного и недорогого способа борьбы с коррозией металла.

Ржавеют… все!
Выше в статье упоминался такой известный центр борьбы с коррозией, как Шведский институт коррозии (ШИК) — одна из наиболее авторитетных организаций в данной области.
Раз в несколько лет ученые института проводят интересное исследование: берут кузова хорошо потрудившихся автомобилей, вырезают из них наиболее подверженные коррозии «фрагменты» (участки порогов, колесных арок, кромок дверей и т.д.) и оценивают степень их коррозионного поражения.
Важно отметить, что среди исследуемых кузовов есть как защищенные (оцинковкой и/или антикором), так и кузова без какой либо дополнительной антикоррозионной защиты (просто окрашенные детали). Так вот, ШИК утверждает, что наилучшей защитой автомобильного кузова является лишь сочетание «цинк плюс антикор»
А вот все остальные варианты, включая «просто оцинковку» или «просто антикор», по словам ученых — плохи
Так вот, ШИК утверждает, что наилучшей защитой автомобильного кузова является лишь сочетание «цинк плюс антикор». А вот все остальные варианты, включая «просто оцинковку» или «просто антикор», по словам ученых — плохи.
ВОДОРОДНАЯ И КИСЛОРОДНАЯ КОРРОЗИЯ
Коррозия металлов часто подразделяется на водородную и кислородную.
Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии, или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:

Если водород не выделяется, что часто происходит в нейтральной или сильнощелочной среде, происходит восстановление кислорода и возникает кислородная коррозия, или коррозия с кислородной деполяризацией:
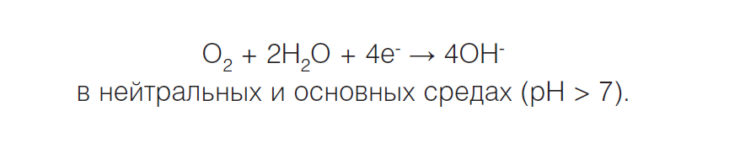
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов, но и в случае использования одного металла, если, к примеру, структура его поверхности неоднородна.
Исходя из того, что возникновение коррозии возможно только при уменьшении энергии поверхностных сил в том или другом материале, возможность коррозии с водородной и кислородной деполяризацией может быть установлена с помощью формулы, связывающей энергию Гиббса и напряжение гальванического элемента:
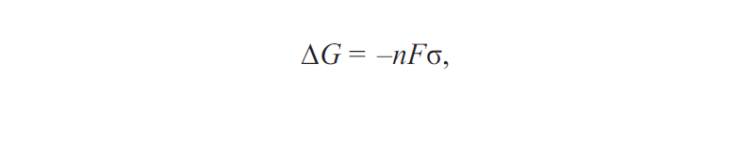
где G — энергия Гиббса; n — напряжение гальванического элемента; F — площадь гальванического элемента; s — коэффициент, зависящий от материала гальванического элемента.
Коррозия возможна при условии, если DG < 0.
В зависимости от величины потенциала металла по отношению к потенциалу водородного или кислородного электрода, металлы можно разделить на три группы.
Если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные и щелочноземельные металлы: Al, Zn и др.
Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода, то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. К этим металлам относятся Cd, Ni, Sn и др. Если потенциал металла положительнее потенциа ла кислородного электрода, то коррозия металла невозможна. Это — благородные металлы, например Au, Ag, Pt.
Популярные темы сообщений
- Осевое вращение земли Ещё со времен до нашей эры человечество обеспокоилось вопросом передвижения небесных тел и смены условий жизни на Земле. Движение луны и её фазы, заход и восход солнца, безостановочная смена времени суток и погоды,
- Македонский Александр Александр Македонский родился в 356 году до н.э. в городе Пелла – столице Древней Македонии. Отец Александра – царь Филипп II – был доблестным и храбрым воином. У него Александр учился военному ремеслу и искусству править.
- Город Армавир Армавир — это город, расположенный в Краснодарском крае, на левом берегу реки Кубань. Этот населенный пункт имеет долгую историю. Впервые он упоминается в 1839 году. В это время черкесские армяне основали
Что такое коррозия?
Слово «коррозия» происходит от латинского «corrodo – грызу». Встречаются ссылки и на позднелатинское «corrosio – разъедание». Но так или иначе:
Хотя коррозию чаще всего связывают с металлами, ей также подвергаются бетон, камень, керамика, дерево, пластмассы. Применительно к полимерным материалам, правда, чаще используется термин деструкция или старение.
Коррозия и ржавчина — не одно и то же
В определении коррозии абзацем выше не зря выделено слово «процесс». Дело в том, коррозию частенько приравнивают к термину «ржавчина». Однако это не синонимы. Коррозия — это именно процесс, в то время как ржавчина — один из результатов этого процесса.
Также стоит отметить, что ржавчина — продукт коррозии исключительно железа и его сплавов (таких как сталь или чугун). Поэтому, когда говорим «ржавеет сталь», то подразумеваем, что ржавеет железо в ее составе.

Если ржавчина относится только к железу, значит другие металлы не ржавеют? Не ржавеют, но это не значит, что они не корродируют. Просто продукты коррозии у них другие.
Например, медь, корродируя, покрывается красивым по цвету зеленоватым налетом (патиной). Серебро на воздухе тускнеет — это на его поверхности образуется налет сульфида, чья тонкая пленка придает металлу характерную розоватую окраску.
 Патина — продукт коррозии меди и ее сплавов
Патина — продукт коррозии меди и ее сплавов
Механизм протекания коррозионных процессов
Разнообразие условий и сред, в которых протекают коррозионные процессы, очень широко, поэтому сложно дать единую классификацию встречающихся случаев коррозии. Но, несмотря на это, все коррозионные процессы имеют не только общий результат — разрушение металла, но и единую химическую сущность — окисление.
Упрощенно окисление можно назвать процессом обмена веществ электронами. Когда одно вещество окисляется (отдает электроны), другое, наоборот, восстанавливается (получает электроны).
Например, в реакции…
… атом цинка теряет два электрона (окисляется), а молекула хлора присоединяет их (восстанавливается).
Частицы, которые отдают электроны и окисляются, называются восстановителями, а частицы, которые принимают электроны и восстанавливаются, называются окислителями. Два этих процесса (окисление и восстановление) взаимосвязаны и всегда протекают одновременно.

Такие вот реакции, которые в химии называются окислительно-восстановительными, лежат в основе любого коррозионного процесса.
Склонность к окислению у разных металлов неодинакова. Чтобы понять, у каких она больше, а у каких меньше, вспомним школьный курс химии. Было там такое понятие как электрохимический ряд напряжений (активности) металлов, в котором все металлы расположены слева направо в порядке повышения «благородности».
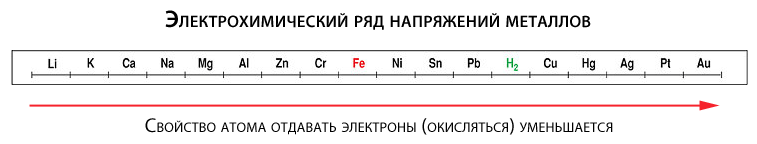
Так вот, металлы, расположенные в ряду левее, более склонны к отдаче электронов (а значит и к окислению), чем металлы, стоящие правее. Например, железо (Fe) больше подвержено окислению, чем более благородная медь (Cu). Отдельные металлы (например, золото), могут отдавать электроны только при определенных экстремальных условиях.
К ряду активности вернемся немного позже, а сейчас поговорим об основных видах коррозии.
Краска для защиты металла: особенности и этапы нанесения
Химтраст производит краски, которые обеспечивают надежную защиту поверхности металла от коррозии.
«Эмаль ПФ-115» и «Грунт ГФ-021» рекомендуем использовать в комплексе для эффективного антикоррозионного действия, снижения расхода, прочного покрытия. Рассмотрим пошагово технологию нанесения.
Поверхность тщательно очищаем от загрязнений, обезжириваем при необходимости.
«Грунт ГФ-021» перемешиваем в течение 5 минут на скорости 300–450 об/мин миксером со спиралевидной насадкой, уделяем внимание области на дне, у стенок тары. Для обеспечения рабочей вязкости разбавляем состав уайт-спиритом, сольвентом или их смесью в пропорции 1:1.
Наносим «Грунт ГФ-021» в два мокрых слоя по 25–35 мкм кистью, валиком, шпателем, аппаратом безвоздушного распыления
Время межслойной сушки — 2 часа при температуре 25 °С.
Чтобы «Эмаль ПФ-115» выполнила функцию защиты металла от коррозии, обеспечиваем материалу рабочую температуру — 15–25 °С. Перемешиваем состав миксером со спиралевидной насадкой на скорости 300–450 об/мин. Разбавляем при необходимости до обеспечения рабочей вязкости уайт-спиритом, сольвентом или их смесью в соотношении 1:1 по массе.
Наносим «Эмаль ПФ-115» в два мокрых слоя по 25–35 мкм кистью, валиком, шпателем, аппаратом безвоздушного распыления. Время межслойной сушки — 2 часа при температуре 25 °С.
Важно! Не используйте материал, если обнаружили, что упаковка негерметична, повреждена или истек срок годности состава.
 |  |
Грунт-эмаль «Химтраст Антикор 3 в 1» — модифицированный состав, который не требует нанесения дополнительного грунтовочного слоя. Состав колеруется по стандартному каталогу RAL.
«Антикор 3 в 1» наносить можно безвоздушным и пневматическим распылением, кистью или валиком на заранее очищенную, обезжиренную поверхность металла в 2–3 слоя. Допустимо нанесение грунт-эмали на плотно сцепленные остатки ржавчины — до 70 мкм, остатки старого покрытия, плотно сцепленные с металлом.
Интервал межслойной выдержки — 1,5 часа при температуре (20±2) °С. Толщина готового покрытия после нанесения не должна превышать 120 мкм. При необходимости состав можно разбавить ксилолом или толуолом, но не более 10 % от массы грунт-эмали. Финишное покрытие после полимеризации — однородное полуглянцевое. Допустимый температурный диапазон эксплуатации от -40 °С до +140 °С.
Мы провели испытания методом А по ГОСТ 9.403–80 «Методы испытаний на стойкость к статическому воздействию жидкостей» для состава «Антикор 3 в 1», чтобы оценить стойкость к воздействию воды, раствора соли, масел. Время, в течение которого образцы подвергались испытаниям: 24 часа. Для погружения образцов подготовили 4 вида растворов:
- вода дистиллированная по ГОСТ 6709–72;
- натрий хлористый по ГОСТ 4233–77, 3%-й раствор;
- минеральное масло по ГОСТ 20799–88;
- трансформаторное масло.
Смотрите на видео результаты испытания и правильную технологию нанесения «Антикор 3 в 1».
При выборе материалов для защиты поверхности металла от коррозии ориентируйтесь на качественные характеристики состава:
|
|---|
Современные лакокрасочные материалы — превентивная мера по защите металлов и сплавов от коррозии. Эффективность окрашивания зависит от качества материалов и подготовки поверхности — на субстрате металла должны отсутствовать дефекты, загрязнения в области сварочных швов, завернувшиеся корки, окалина.
Материалы поставляем в металлических ведрах 20 кг. Продукция всегда в наличии к заказу. Доставляем материалы во все регионы России и СНГ. Действует скидочная программа.
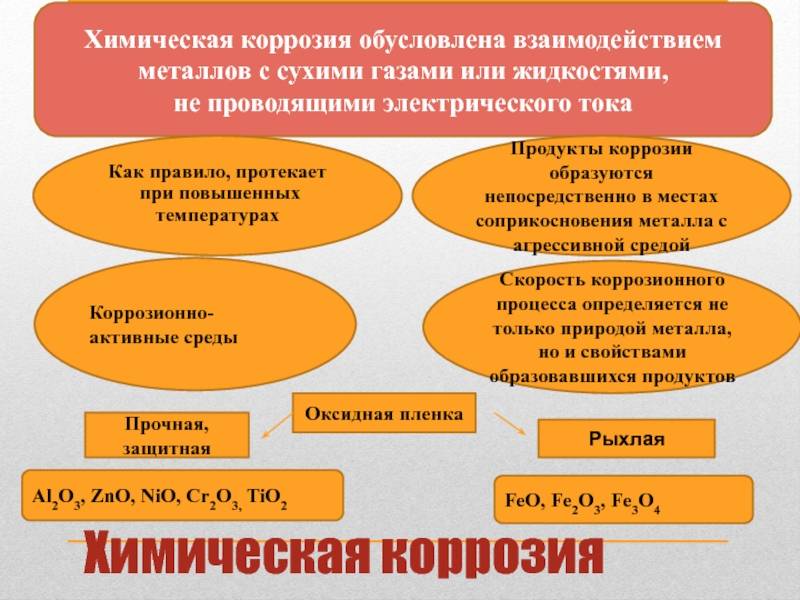
Влияние химической коррозии на металлы
Химическая коррозия является одним из основных факторов, негативно влияющих на металлы. Взаимодействие металла с агрессивными химическими средами приводит к нарушению его структуры и свойств. Химическая коррозия может проявляться в различных формах, таких как ржавление, образование оксидных пленок и потеря металла.
Коррозия воздействует на металлы путем распада их структуры под влиянием различных факторов, таких как кислоты, щелочи, соли, влажность и температура. В результате такого воздействия металлы теряют свою прочность, становятся хрупкими и подверженными разрушению.
Одной из форм химической коррозии является ржавление, которое происходит, когда металл взаимодействует с водой и кислородом. Под воздействием влаги и кислорода происходит окисление металла, образуются оксидные соединения, которые приводят к образованию коррозионного слоя на поверхности металла.
Для защиты металлов от влияния химической коррозии применяются различные методы и способы. Одним из них является нанесение защитных покрытий на поверхность металла, таких как лаки, эмали, порошковая краска. Такие покрытия предотвращают проникновение влаги и вредных химических веществ на поверхность металла, что способствует его сохранению на более длительный срок.
Важным аспектом защиты от химической коррозии является выбор правильного материала для конкретных условий эксплуатации. Некоторые металлы обладают более высокой устойчивостью к коррозии, например нержавеющая сталь, алюминий или титан. При выборе материала необходимо учитывать химическую среду, температурные условия и другие факторы, которые могут повлиять на коррозионную стойкость металла.
Подпленочная коррозия
Подпленочная коррозия – вид повреждения, которое возникает под слоем лакокрасочного материала (ЛКМ) или защитной пленки с низким показателем эластичности
Такой вид повреждения принято называть подпленочной коррозией.
Причиной подпленочной коррозии может быть нарушение технологии нанесения покрытий. Например, выполнение окрасочных работ при повышенной влажности воздуха, когда на поверхности металла образуется даже незначительная по толщине пленка воды, приводит к тому, что влага остается под защитным слоем сформировавшегося покрытия. В пленке воды под слоем краски начинается электрохимическая коррозия. Продукты окисления металла вспучиваются, вызывая отрыв лакокрасочного покрытия от подложки. Чем более толстым и жестким будет слой ЛКП или защитной пленки, тем б?льшими будут площади подпленочной коррозии.
Коррозионное растрескивание металлов под напряжением
Коррозионное растрескивание металлов под напряжением (КРН) — это один из видов коррозионного разрушения, при котором в металле зарождается и развивается множество трещин. Возникает КРН при одновременном воздействии на металл агрессивной коррозионной среды и статических или циклических растягивающих напряжений. Коррозионному растрескиванию могут подвергаться все металлы и сплавы, которые находятся в напряженном состоянии. Большое влияние на интенсивность коррозионного растрескивания оказывает коррозионная среда (ее характер, состав и концентрация агрессивных компонентов).
Как правило, при коррозионном растрескивании металлов возникают и распространяются тонкие трещины. Растрескивание может быть межкристаллитным, транскристаллитным и смешанным, но в любом случае характеризуется малыми остаточными деформациями. Основными причинами возникновения коррозионного растрескивания металла являются: неравномерное растворение участков поверхности, приводящее к образованию дефектов — концентраторов напряжения; охрупчивание металла водородом, выделяющимся на катодных участках; адсорбция активных компонентов среды на поверхности и активация анодного процесса.
Коррозионное растрескивание — очень опасный вид разрушения металла, так как не всегда его можно вовремя заметить. Чаще всего коррозионному растрескиванию подвергаются металлы, в которых после механической или термической обработки присутствуют остаточные напряжения, или металлические изделия, эксплуатируемые при повышенной температуре и давлении. Встречается коррозионное растрескивание при сварке, сборке или монтаже металлических конструкций и т.п.
Коррозия металлов и их пассивация
Поверхность металла при контакте с коррозионным агентом подвергается окислению – на поверхности образуется оксидная пленка металла. Не всегда это нежелательное явление. Пассивация – явление, при котором на поверхности металла образуется достаточно плотная и прочно связанная оксидная пленка. Ее задача – защитить материал от дальнейшей деградации (дальнейшего окисления).
Явление пассивации можно наблюдать, например, в случае алюминия. Хотя это высокореактивный металл, он устойчив к коррозии благодаря пассивации. Металлы обычно подвергаются процессам пассивации – это один из антикоррозионных методов. Существует также естественная пассивация. Ее можно наблюдать у меди, на поверхности которой образуется зеленый налет, называемый патиной.
Виды коррозии бетона
Хрупкость бетона может вызываться одним из трех видов коррозии. Довольно нередко встречается изменение структуры данного материала. Рассмотрим же, из-за чего это происходит.
Наиболее распространенным видом коррозии следует назвать разрушение цементного камня. Как правило, это происходит тогда, когда жидкость и атмосферные осадки постоянно воздействуют на материал. Из-за этого структура материала разрушается. Ниже есть более подробные примеры коррозии металлов:
- Взаимодействие с кислотами. Если цементный камень будет постоянно под воздействием данных материалов, то образуется довольно агрессивный элемент, который вреден для покрытия. Речь идет о бикарбонате кальция.
- Кристаллизация труднорастворимых веществ. Здесь речь идет о коррозии. Из-за того что грибки, споры и другие вещества попадают в поры, бетонное покрытие начинает быстро разрушаться.
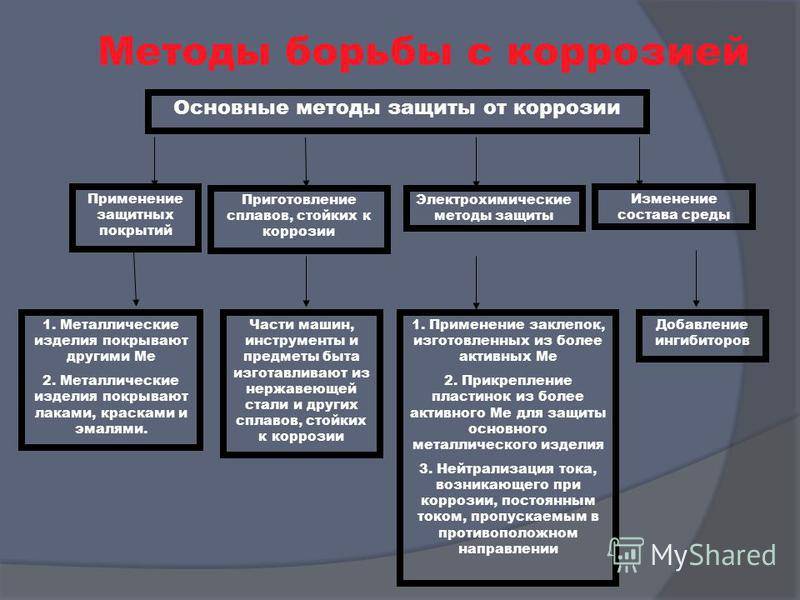
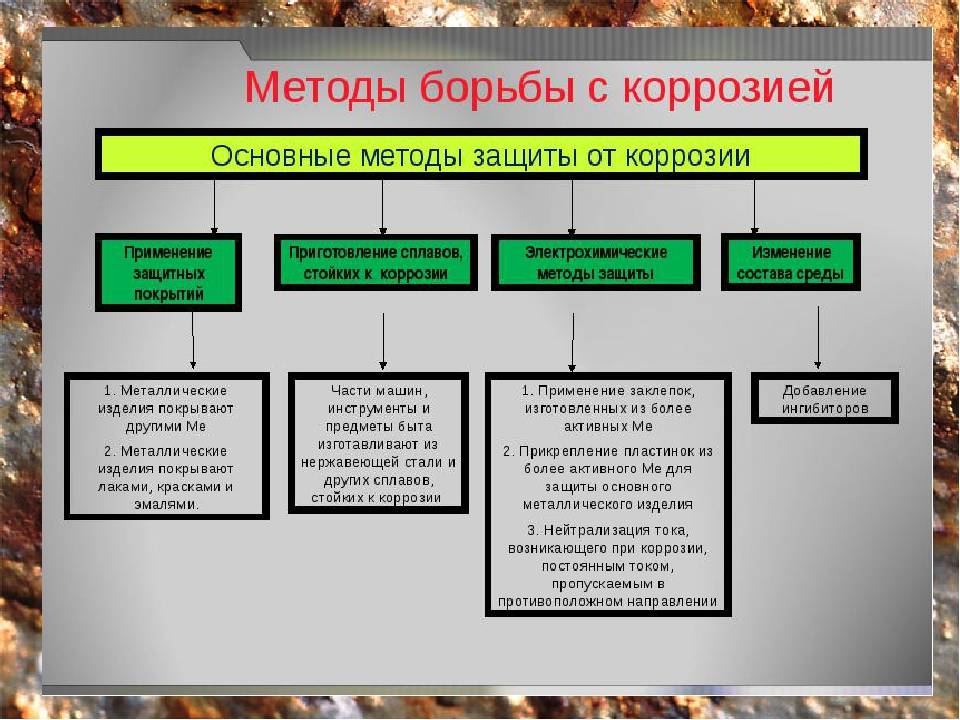
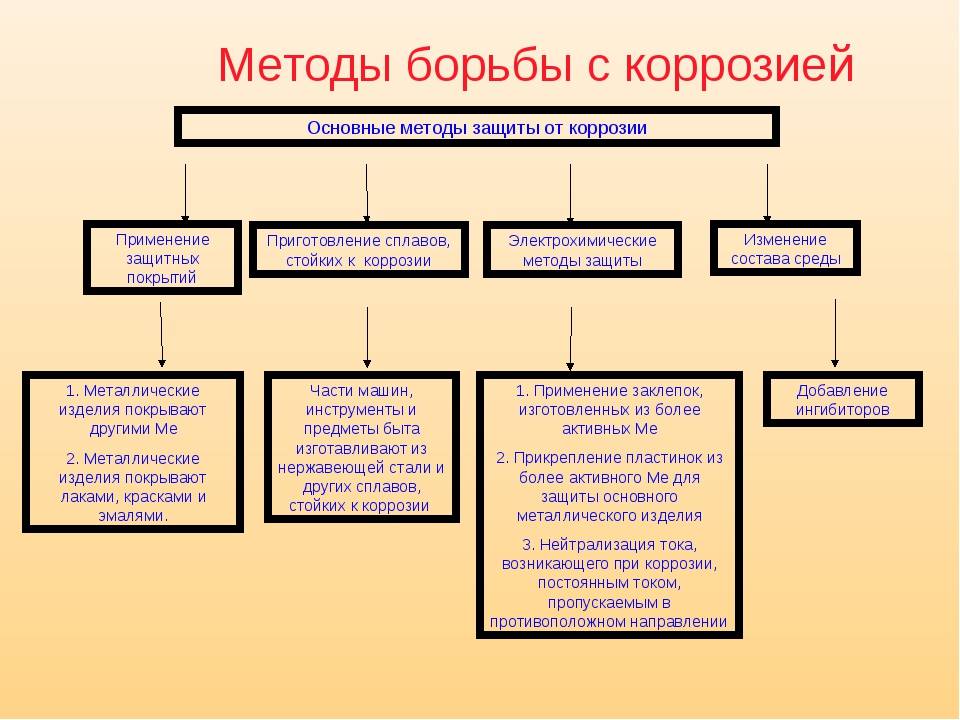
Способы защиты металла
Электрохимическая коррозия – одно из основных препятствий, которые встречаются на пути человеческой деятельности. Защита от воздействия разрушительных процессов и их протекания на поверхности конструкций и сооружений – одна из перманентных и насущных задач любого промышленного производства, и любой бытовой деятельности человека.

Разработано несколько способов такой защиты, и все они активно применяются в повседневном цикле жизнедеятельности:
- Электрохимическая защита – электролитическое по принципу работы использование химических закономерностей, защищает металл с помощью анодного, катодного и протекторного принципа.
- Электроискровая обработка с использованием различных установок – бесконтактных, контактных, анодно-механических.
- Электродуговое напыление – основное преимущество в толщине наносимого слоя и относительной дешевизне производимого процесса.
- Эффективная антикоррозийная обработка – удаление загрязнений и очистка обрабатываемой поверхности, с последующим нанесением на поверхность сначала противокоррозионного, а затем и дополнительного защитного слоя.
Все эти способы наработаны в процессе деятельности человека с целью защиты инструментария, средств передвижения и транспортировки на стыке нескольких промышленных отраслей, и с использованием научных достижений.
Электрохимическая коррозия, которая является естественным процессом разрушения поверхности металла под воздействием нейтральных или агрессивных факторов окружающей среды, представляет собой сложную проблему. Убытки от нее терпят и машиностроительные, и транспортные, и промышленные предприятия, средства передвижения. И это проблема, которая требует ежедневного разрешения.
Способы защитить металл от коррозии
Антикоррозийная защита может проводиться такими методами как:
- Повышение общей коррозионной устойчивости металла методом изменения его хим. структуры;
- Также может использоваться изолирование поверхности металла с применением особенных покрытий;
- Снижение показателя агрессивности места, где применяется металл;
- Применение токов, увеличивающих устойчивость к влиянию коррозии.
Защитные составы достаточно легки в применении, недорого стоят и быстро обновляются при желании, а также создают более декоративный вид для металлического изделия.
Протекция от коррозии обусловливается физической изоляцией металла, или мощным электрическим-химическим влиянием антикоррозионного покрытия на поверхности. Главными минусами большей части лакокрасочных материалов является их слабая водопроницаемость, а иногда и слабая температурная устойчивость.
Защитная пленка как преграда разрушению
Покрытие верхней части металла особым лакокрасочным слоем служит отличной преградой для образования коррозии, а следовательно, способно снижать распространение коррозии. Особое значение в этом деле имеет качество покрытия(используется антикоррозийная краска) – учитывается толщина слоя краски и его пористость.
Также качество покрытия металла будет зависеть от уровня подготовки поверхности и метода работы с антикоррозионным покрытием. Любая ржавчина должны быть зачищена.
Антикоррозионные краски и лаки
Антикоррозийная краска по металлу представляют собой вещество, предохраняющее металл от воздействия опасной внешней среды.
- Составом смазывают поврежденную поверхность.
- Такой материал создает более устойчивое к атмосферному влиянию покрытие.
- Максимальная укрывистость к ржавчине.
Также может использоваться краска по ржавчине. Краска по ржавчине при ее своевременном и правильном нанесении на металл гарантирует долгую протекцию трубопроводов и металлических систем. Такая краска способна защитить элементы механизмов и промышленных аппаратов, а также деталей машин от пагубного влияния ржавчины. С помощью краски проводится обработка технологическим систем и прочего оборудования, в том числе гидротехнических механизмов и мостов.
- Элакор-ПУ — эмали для обработки металлических деталей и краска по металлу.
- Толстослойное антикоррозионное покрытие на основе алкидных смол. FEIDAL Coatings.
- Эмаль ПФ, ПФ 115 и эмаль ПФ-1189. «Сигма краски».
- Антикоррозийная краска NOR-MAALI. Применяется в качестве поверхностной краски. Производитель CARBOLINE — Норвегия, Линейка красок Nor-Maali достаточно широкая – около сотни видов. В основном они используются в промышленных целях: судостроении, мостостроении, строительстве
Однако не любая краска может гарантировать лучший показатель защиты. Стоит рассмотреть виды противокоррозийных эмалей. Специалисты используют ЛКМ для снижения цены работ. Кроме этого, данная продукция ускоряет технологический процесс нанесения покрытия.
Заключение
В статье было описано, что такое коррозия и какие виды она имеет. Сейчас уже любой человек после прочтения данной статьи сможет понять, как защитить любой материал от старения. По большому счету сделать это довольно легко, зная все необходимые инструкции. Главное — понимать все характеристики окружающей среды, в которой материал используется. Если изделия находятся в месте, где происходят постоянные вибрации, а также имеются сильнейшие нагрузки, то в лакокрасочных покрытиях будут возникать трещины. Из-за этого на металл станет попадать влага, соответственно, процесс коррозии начинается незамедлительно. В таких случаях лучше дополнительно использовать резиновые герметики и прокладки, тогда покрытие будет служить немного дольше.
Дополнительно нужно сказать, что конструкция при преждевременной деформации будет быстро портиться и стареть. Соответственно, это может привести к совершенно непредвиденным обстоятельствам. Это будет приносить материальную ущерб и может закончиться гибелью человека
Соответственно, защите от коррозии следует уделять особое внимание